8月3日,朱国萍教授团队在生物化学与分子生物学领域TOP期刊《Journal of Biological Chemistry》发表题为“A single amino acid residue tunes the stability of the fully reduced flavin cofactor and photorepair activity in photolyases”的研究论文,朱国萍教授为该论文通讯作者,博士文斌和皖南医学院徐蕾教授为共同第一作者。
自然条件下,阳光中的紫外线会引起DNA片段上的胸腺嘧啶产生二聚体,分别是环丁烷嘧啶二聚体(cyclobutane pyrimidine dimers, CPD)与6-4光产物(6-4 photoproducts)。这两类损伤会破坏DNA结构,从而抑制DNA的复制与转录,引起细胞内信号通路的紊乱,甚至造成细胞死亡。而光修复酶主要是一类可以直接修复紫外线造成的DNA损伤的蛋白,它通过吸收315-500 nm波长范围的光,并以此为能量催化修复DNA上的紫外损伤,恢复DNA的正常结构。根据修复的底物不同,光修复酶进一步分为CPD光修复酶和6−4光修复酶两大类。
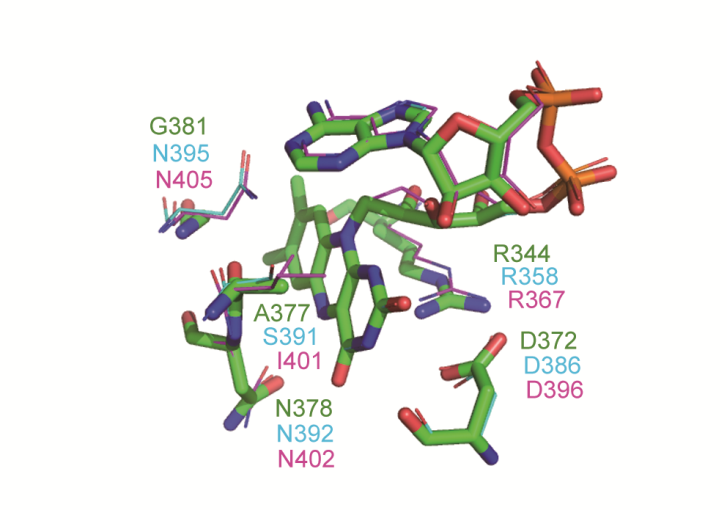
FAD辅酶结合位点
光修复酶通常包含黄素腺嘌呤二核苷酸(Flavin Adenine Dinucleotide,FAD)等辅酶吸收光能来执行功能。FAD作为电子传递的中间体,可以通过得失一个或是两个电子完成氧化还原反应。FAD存在3种基本形式:完全氧化型(fully oxidation, OX);单电子还原态即自由基型(semiquinone, SQ);双电子还原态即完全还原型(hydroquinone, HQ)。其中HQ状态对于光修复酶的活性至关重要。本研究通过序列比对及结构分析,发现了一个关键氨基酸在不同的光修复酶蛋白中呈现出一定的分布特点,在大肠杆菌(Escherichia coli)中该位点为Ala377,所以以下统称为377位点。在CPD光修复酶中,377位点主要是丙氨酸、丝氨酸、天冬酰胺等空间位阻小或有极性的氨基酸;而在6-4光修复酶中,377位点则偏好于异亮氨酸、亮氨酸、缬氨酸等空间位阻大的疏水性氨基酸。由于该氨基酸残基位于FAD的结合口袋,因此推测该位点对于FAD的氧化还原性质或稳定性有一定的作用,进而对光修复酶的功能产生影响。本研究通过定点突变分别构建大肠杆菌CPD光修复酶、铜绿微囊藻DASH蛋白(Microcystis aeruginosa)、三角褐指藻(Phaeodactylum tricornutum)6-4光修复酶在377位点的突变体酶,对377位点的体外及体内功能进行深入探究。本研究证明了377位点残基能够影响光修复酶HQ的稳定性,并且能调节光修复酶的活性。
朱国萍教授团队于2010年开始开展光修复酶的功能与进化研究,至今已有12年。该团队已在《Molecular Biology and Evolution》、《Journal of Biological Chemistry》、《ChemBioChem》、《Journal of Photochemistry and Photobiology B》等国际期刊发表系列论文。该项研究是朱国萍教授团队在大分子功能与进化生物学方向研究的又一次进展,对于认识光修复酶家族的功能和进化具有重要意义。
论文链接:https://doi.org/10.1016/j.jbc.2022.102188

